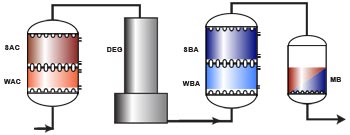
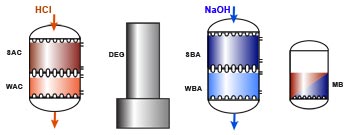
Principaux procédés
d'échange d'ions en traitement d'eau
Introduction
L'échange d'ions est utilisé dans plusieurs applications en traitement d'eau :
- Adoucissement (élimination de la dureté)
- Décarbonatation (élimination du bicarbonate)
- Décarbonatation et adoucissement combinés
- Décationisation (élimination de tous les cations)
- Déminéralisation (élimination de tous les ions)
- Lits mélangés (finition)
- Dénitratation
- Élimination sélective de divers autres contaminants
Adoucissement
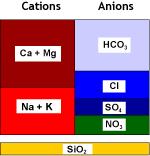
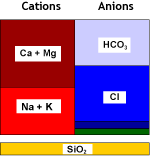
L'eau naturelle contient des ions calcium et magnésium (voir analyse d'eau) qui forment des sels peu solubles. Ces cations, ainsi que les autres métaux alcalino-terreux que sont le strontium et le baryum — qui sont moins fréquents mais forment des sels encore moins solubles — sont appelés globalement "dureté" de l'eau. Lorsque l'eau s'évapore, même très peu, ces cations précipitent. C'est ce que vous voyez lorsque vous faites bouillir de l'eau dans une casserole ou une bouilloire électrique.
La dureté de l'eau entartre les canalisations et les chaudières, qu'elles soient domestiques (chez vous) ou industrielles. Elle peut aussi créer une turbidité indésirable dans la bière ou les boissons. Les sels de calcium se déposent sur les verres dans votre lave-vaisselle si l'eau de ville est dure et si vous avez oublié d'ajouter du sel dans la machine.
Les résines échangeuses de cations fortement acides (SAC, voir les types de résines) utilisées sous la forme sodium éliminent de l'eau ces cations alcalino-terreux divalents. Une fois que l'adoucisseur est chargé avec ces cations, on peut le régénérer avec du chlorure de sodium (NaCl, sel de table).
Réactions
Ici l'exemple du calcium :
2 R-Na + Ca++  R2-Ca + 2 Na+
R2-Ca + 2 Na+
R représente la résine, qui est initialement sour la forme sodium. La réaction avec le magnésium est identique.
La réaction ci-dessus est une équilibre, qui peut être inversé en augmentant la concentration du sodium dans le membre de droite. C'est ce qui se passe avec NaCl, et la réaction de régénération est alors :
R2-Ca + 2 Na+  2 R-Na + Ca++
2 R-Na + Ca++
Ce qui se passe dans l'eau
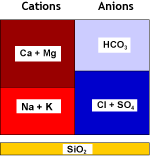 Eau brute |
SAC (Na) |
 Eau adoucie |
La salinité totale de l'eau n'a pas changé, seule la dureté a été remplacée par du sodium. Il peut y avoir une petite dureté résiduelle, dont la concentration dépend des conditions de régénération.
| Régénération à co-courant | Dépend de la qualité de l'eau brute et du taux de régénération |
| Régénération à contre-courant | < 0.02 meq/l (1 mg/l en CaCO3) |
Applications
Exemples d'utilisation d'un adoucisseur :
- Traitement de l'eau d'appoint de chaudières basse-pression.
- En Europe, la plupart des lave-vaisselle sont munis d'une cartouche adoucissante sous leur plancher.
- Les fabriques de bière et de boissons traitent l'eau destinée à leurs produits avec des résines autorisées dans l'industrie alimentaire.
Décarbonatation
Ce procédé utilise une résine échangeuse de cations faiblement acide (WAC). Ces résines sont capables d'éliminer la dureté de l'eau lorsque celle-ci contient aussi des bicarbonates, qui sont des anions alcalins. Après le traitement, l'eau contient du dioxyde de carbone (gaz carbonique) qui peut être éliminé à l'aide d'un dégazeur. La résine WAC se régénère très facilement avec un acide, généralement l'acide chlorhydrique.
Réactions
Ici l'exemple du calcium :
2 R-H + Ca++(HCO3–)2  R2-Ca + 2 H+ + 2 HCO3–
R2-Ca + 2 H+ + 2 HCO3–
et les cations hydrogène (H+) se combinent avec les anions bicarbonate pour former du dioxyde de carbone et de l'eau :
H+ + HCO3–  CO2 + H2O
CO2 + H2O
Ce qui se passe dans l'eau
 Eau brute |
WAC (H) |
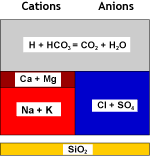 Eau décarbonatée |
| Recombinaison de l'hydrogène et du bicarbonate et élimination du gaz carbonique à l'aide d'un dégazeur : | ||
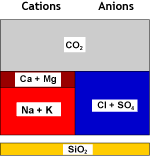 Eau décarbonatée |
DEG |
 Eau dégazée |
La salinité a diminué. La dureté temporaire n'est plus là.
| Dureté temporaire | Pratiquement 0 |
| Dureté totale | = SAF |
| pH | 6 à 7 |
Applications
On utilise la décarbonatation :
- En brasserie.
- Dans les cartouches filtrantes domestiques.
- Pour l'alimentation de chaudières basse-pression.
- Comme première étape en déminéralisation, avant échange sur une résine fortement acide.
Décarbonatation et adoucissement combinés
Ce procédé est parfois appelé Carbomix, bien que les résines utilisées ne soiuent pas mélangées.Il met en œuvre deux types d'échangeur, une WAC (faiblement acide) sous forme H+ suivie d'une SAC (fortement acide) sous forme Na+. Les deux résines peuvent être mises dans une seule colonne (en Stratabed), ou dans des colonnes séparées. Ce système n'est utile que lorsque la dureté (TH) est supérieure à l'alcalinité (TAC), sinon une résine WAC suffit.
Les réactions d'échange sont présentées dans les deux paragraphes précédents, et nous ne les répéterons pas ici. Pour que le système fonctionne, il faut que la décarbonatation ait lieu en premier.
Ce qui se passe dans l'eau
La première étape est la décarbonatation, qui est l'élimination de la dureté temporaire :
 Eau brute |
WAC (H) |
 Eau décarbonatée |
La seconde étape est l'élimination de la dureté résiduelle (dureté permanente). Le CO2 produit peut être dégazé.
 Eau décarbonatée |
SAC (Na)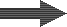 |
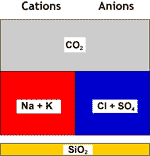 Décarbonatée+adoucie |
DEG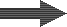 |
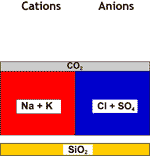 Eau finale |
Toute la dureté est partie, et la salinité a baissé.
| Dureté totale | 0.02 à 0.2 meq/L |
| Na | Concentration réduite à hauteur du SAF |
| pH | 6 à 7 |
| SAF | Inchangé |
| CO2 | 0.2 à 0.3 meq/L |
La régénération se fait endeux étapes, en commençant par l'acide (HCl de préférence), puis la saumure.
Décationisation
L'élimination de tous les cations est rarement pratiquée seule, elle constitue le plus souvent la première étape d'une déminéralisation. On peut citer comme exception les traitements de condensats où un échangeur de cations précède un lit mélangé.
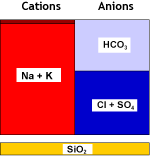
Pour la décationisation, on utilise une résine fortement acide (SAC) sous forme hydrogène (H+).
Réactions
Ici l'exemple du sodium, mais tous les cations réagissent de la même manière :
R-H + Na+  R-Na + H+
R-Na + H+
Cette réaction d'équilibre est inversée pour la régénération en augmentant la concentration des ions hydrogène dans le membre de droite. Ceci se fait à l'aide d'un acide fort, HCl or H2SO4 :
R-Na + H+  R-H + Na+
R-H + Na+
Ce qui se passe dans l'eau
 Eau brute |
SAC (H) |
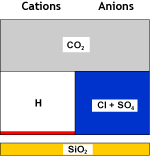 Eau décationnée |
DEG |
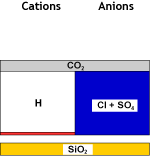 Eau décat. dégazée |
Dans la seconde étape, un dégazeur est utilisé à nouveau pour éliminer le dioxyde de carbone qui s'est formé par combinaison des cations hydrogène créés et des anions bicarbonate. La salinité est réduite, et l'eau est maintenant acide. Le dégazeur n'élimine pas tout le CO2 et une petite concentration résiduelle de sodium est montrée sur les images.
| Dureté totale | 0 |
| Na (regen. co-courant) | 0.5 à 1 mg/L |
| Na (regen. contre-courant) | < 0.1 mg/L |
| pH | 2 à 5 |
| SAF | Inchangée |
| CO2 | 0.2 à 0.3 meq/L |
Déminéralisation
Dans de nombreuses applications, il faut éliminer de l'eau tous les ions. Par exemple, lorsque de l'eau est chauffée pour produire de la vapeur, toute impureté peut précipiter et causer des problèmes. Comme l'eau contient des cations et des anions, il faut utilier deux types différents de résine : une résine échangeuse de cations et une résine échangeuse d'anions. En combinant ces deux résines, on peut produire de l'eau pure, comme nous l'avons montré dans l'introduction générale. On appelle parfois ce procédé désionisation. L'échangeur de cations est utilisé sous forme hydrogène (H+) et l'échangeur d'anions sour forme hydroxyde (OH–). Il faut donc régénérer le premier avec un acide et le second avec une base.
On utilise un dégazeur après l'échangeur de cations pour éliminer le dioxyde de carbone lorsque l'eau brute contient des bicarbonates.
 Le plus souvent, l'échangeur de cations est placé en tête ; dans le cas contraire, si l'eau contenait de la dureté, celle-ci précipiterait dans l'environnement alcalin de la résine échangeuse d'anions sous forme OH— par formation de Ca(OH)2 ou de CaCO3 dont la solubilité est faible.
Le plus souvent, l'échangeur de cations est placé en tête ; dans le cas contraire, si l'eau contenait de la dureté, celle-ci précipiterait dans l'environnement alcalin de la résine échangeuse d'anions sous forme OH— par formation de Ca(OH)2 ou de CaCO3 dont la solubilité est faible.
Chaînage SAC – (DEG) – SBA
Considérons tout d'abord une simple chaîne de déminéralisation comprenant un échangeur de cations fort sous forme H+, un dégazeur (en option) et un échangeur d'anions fort sous forme OH–. La première étape est une décationisation semblable à celle que nous venons de voir :RSAC-H + Na+  RSAC-Na + H+
RSAC-Na + H+
Si l'on prend le calcium à la place du sodium (ou tout autre cation divalent tel que le magnésium) on a :
2 RSAC-H + Ca++  (RSAC)2-Ca + 2 H+
(RSAC)2-Ca + 2 H+
Dans la seconde étape, tous les anions sont éliminés par la résine fortement basique :
RSBA-OH + Cl– 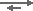 RSBA-Cl + OH–
RSBA-Cl + OH–
Les acides faibles créés par l'échange de cations qui sont l'acide carbonique et l'acide silicique (H2CO3 et H2SiO3) sont éliminés de la même façon :
RSBA-OH + HCO3– 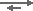 RSBA-HCO3– + OH–
RSBA-HCO3– + OH–
Et finalement, les ions H+ ions créés dans la première étape réagissent avec les ions OH– de la seconde pour produire de nouvelles molécules d'eau. Cette réaction est irréversible :
H+ + OH–  H2O
H2O
Ce qui se passe dans l'eau
| 1. Échange de cations (comme dans le procédé de décationisation) : | ||||
 Eau brute |
SAC (H) |
 Eau décationnée |
DEG |
 Eau décat. dégazée |
| 2. Échange d'anions : | ||||
 Eau décat. dégazée |
SBA (OH)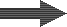 |
 Eau déminéralisée |
||
| Conductivité (régén. co-courant) | 5 à 25 µS/cm |
| Conductivité (régén. contre-courant) | < 1 µS/cm |
| Silice résiduelle (co-courant) | 50 à 200 µg/L |
| Silice résiduelle (contre-courant) | 5 à 40 µg/L |
| Sodium résiduel | Voir décationisation ci-dessus |
| pH | En principe > 7 Ne pas utiliser le pH comme critère de fonctionnement |
L'eau déminéralisée ne contient plus rien, à l'exception de quelques traces de sodium et de silice, car les résines SAC et SBA ont leur sélectivité la plus faible pour ces espèces. Avec une simple chaîne de déminéralisation régénérée à contre-courant, l'eau traitée a une conductivité de seulement 1 µS/cm environ, et une silice résiduelle comprise entre 5 et 50 µg/L selon la concentration de silice dans l'eau brute et les conditions de régénération.
Il est important de noter que la valeur du pH ne doit pas être prise comme moyen de contrôle, car il est impossible de mesurer précisément le pH d'une eau de moins de 5 µS/cm environ.
Régénération
L'échangeur de cations est régénéré avec un acide fort, HCl ou H2SO4 :
R-Na + H+ 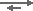 R-H + Na+
R-H + Na+
et l'échangeur d'anions avec une base forte, NaOH dans 99 % des cas :
RSBA-Cl + OH– 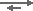 RSBA-OH + Cl–
RSBA-OH + Cl–
Chaînage WAC/SAC – DEG – WBA/SBA
Comme les échangeurs de cations faiblement acides (WAC) et les échangeurs d'anions faiblement basiques (WBA) offrent une capacité élevée et se régénèrent facilement, ils sont combinés avec des échangeurs fortement acides et fortement basiques dans les installations de grande taille. La première étape utilisant la résine WAC est une décarbonatation (éilimination de la dureté carbonatée) et la deuxième, utilisant la résine SAC, élimine tous les cations qui restent. On peut utiliser une résine WAC lorsque l'eau brute contient une forte proportion de dureté et d'alcalinité (bicarbonate).Les résines faiblement basiques (WBA) ne retiennent que les acides forts après l'échange de cations. Elles ne sont pas capable d'éliminer les acides faibles tems que SiO2 et CO2. sous forme régénérée, comme bases libres, elles ne sont pas dissociées, ce qui fait qu'il n'y a pas d'ions OH– libres pour un échange d'anions en milieu neutre. En revanche, leur basicité est suffisante pour fixer les acides forts créés après l'échange de cations :
RWBA + H+Cl–  RWBA.HCl
RWBA.HCl
Dans une dernière étape, il faut donc une résine fortement basique (SBA) pour éliminer les acides faibles :
RSBA-OH + HCO3– 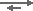 RSBA-HCO3– + OH–
RSBA-HCO3– + OH–
Ce qui se passe dans l'eau
| 1 & 2 : Échange de cations débutant par une décarbonatation (WAC) suivie de l'élimination de tous les cations qui restent (SAC) : | ||||
 Eau brute |
WAC (H) |
 Eau décarbonatée |
SAC (H) |
 Eau décationnée |
| 3 & 4 : Échange d'anions débutant après dégazage par l'élimination des acides forts (WBA) suivie de l'élimination des acides faibles (SBA) : | ||||
 Eau décat. dégazée |
WBA (FB) |
 Partiellement déminéralisée |
SBA (OH) |
 Totalement déminéralisée |
L'image suivante montre une chaîne complète de déminéralisation comprenant une colonne d'échange de cations avec résines faiblement et fortement acides (WAC/SAC), un dégazeur, une colonne d'échange d'anions avec résines faiblement et fortement basiques (WBA/SBA), et un lit mélangé de finition. L'utilisation dun échangeur faiblement acide et d'un dégazeur dépend de la quantité de dureté et d'alcalinité (bicarbonate) dans l'eau brute, comme on l'a vu dans les paragraphes précédents.
Régénération
La régénération se fait en série, ce qui signifie que le régénérant passe d'abord à travers a résine fortement fonctionnelle qui a besoin d'un excès de régénérant et qu'ensuite le régénérant non consommé par la résine forte suffit le plus souvent à régénérer la résine faible sans qu'il soit nécessaire d'en rajouter.
Les résines échangeuses de cations sont régénérées avec un acide fort, HCl de préférence, car H2SO4 peut causer une précipitation du calcium.
Les résines échangeuses d'anions sont régénérés à la soude caustique (NaOH).
La qualité de l'eau traitée est la même que celle d'un chaînage simple SAC—SBA, mais comme les résines faibles sont régénérées "gratuitement", la consommation de régénérants est nettement réduite. De plus, les résines faibles ayant une capacité plus grande que les résines fortes, le volume total de résine est lui aussi réduit.
Applications
Exemples de déminéralisation :
- Eau destinée aux chaudières à haute pression dans les centrales électriques thermiques et nucléaires et dans de nombreuses autres industries. Voir aussi Condensate polishing (en anglais).
- Eau de rinçage nécessaire à la production de semi-conducteurs et autres composants électroniques. Voir Ultrapure water (en anglais).
- Eau de process de diverses industries : chimie, papier, textile et autres.
- Eau pour batteries.
- Eau déminéralisée pour laboratoires.
Lits mélangés de finition
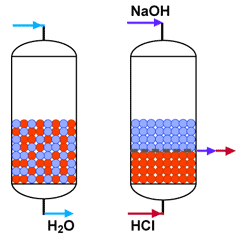
Lit mélangé en production
et en régénération
Ces lits mélangés produisent une eau déminéralisée d'excellente qualité, mais ils sont compliqués à régénérer, car il faut séparer les résines par soulèvement avant la régénération. De plus, les taux de régénération sont élevés, et les conditions de régénération ne sont pas optimales en raison de la faible hauteur de chaque couche et de la difficulté de séparer parfaitement ces couches. Pour ces raisons, les lits mélangés sont en général utilisés pour le traitement d'eau pré-déminéralisée lorsque la durée de cycle est longue.
Ce qui se passe dans l'eau
Il ne reste pratiquement plus rien :
 Eau pré-déminéralisée |
SAC (H) + SBA (OH) |
 Il ne reste rien... |
La finition en lit mélangé produit une eau de conductivité inférieure à 0.1 µS/cm. Avec une construction soignée, on peut atteindre la conductivité de l'eau pure, soit 0.055 µS/cmL La silice résiduelle peut être parfois réduite à 1 µg/L, parfois moins.
La valeur du pH ne doit jamais être considérée comme paramètre de contrôle, car les pH-mètres ne fonctionnent pas à une conductivité de 1 µS/cm ou moins.
| Conductivité | < 0.1 µS/cm |
| Silice résiduelle | 1 à 10 µg/L |
| pH | Non mesurable |
Capacité et durée de cycle
Le schéma et la qualité d'eau traitée montrés ci-dessus s'appliquent à une finition derrière une chaîne primaire de déminéralisation par échange d'ions. Dans ce cas, l'eau qui alimente le lit mélangé ne contient que des traces de sodium et de silice. La capacité utile est généralement limitée par l'échangeur d'anions, et elle est très basse. Néanmoins, la durée de production entre régénération est le plus souvent comprise entre 2 et 4 semaines.
Lorsque l'eau alimentant le lit mélangé de finition contient d'autres ions, ce qui est le cas par exemple après une osmose inverse, la situation est totalement différente. En effet, l'eau osmosée contient souvent une large proportion de gaz carbonique, et c'est celle-ci qui limite la capacité. D'autre part, la qualité d'eau traitée est souvent supérieure à 0.1 µS/cm (mais inférieure à 1 µS/cm), et la durée de cycle n'est que de un à quelques jours.
Applications
- Traitement des eaux pré-déminéralisées par échange d'ion.
- Traitement de perméats d'osmose inverse.
- Traitement de distillats d'eau de mer.
- Traitement de condensats de turbine dans les centrales électriques.
- Traitement de condensats de process dans diverses industries.
- Production d'eau ultra-pure dans l'industrie des semi-conducteurs.
- Colonnes de déminéralisation portable (régénérées en dehors du site).
Dénitratation
On peut éliminer sélectivement les nitrates de l'eau potable en utilisant des résines échangeuses d'anions fortement basiques sous forme chlorure, régénérées au sel. La réaction est la suivante :
RSBA-Cl + NO3–  RSBA-NO3 + Cl–
RSBA-NO3 + Cl–
Ce qui se passe dans l'eau
 Eau brute |
SBA (Cl) |
 Eau dénitratée |
Les résines fortement basiques conventionnelles peuvent être utilisées, mais elles éliminent aussi les sulfates. Voir la table de sélectivité. Il vaut mieux utiliser des résines plus sélectives. Selon le type de résine, tout (résines non sélectives) ou partie (résines sélectives) du sulfate est fixé. Le bicarbonate est éliminé en partie au début du cycle.
Dépend de la composition de l'eau brute, du taux et du mode de régénération.
Toujours régénérer à contre-courant. NO3 résiduel à contre-courant: 2 à 10 mg/L.
Utiliser IXCalc pour une estimation plus précise. Une teneur en sulfate élevée augmente la fuite en nitrate.
Applications
- Principalement en traitement municipal d'eau potable.
Élimination sélective de contaminants divers
L'élimination sélective de métaux et d'autres contaminants par échange d'ions se fait principalement pour le traitement des eaux potables et parfois des eaux résiduaires industrielles. La plupart de ces applications font appel à des résines spéciales, par exemple des résines chélatantes formant des complexes stables avec les métaux.
Exemples
- Déboratation d'eau potable.
- Dénitratation d'eau potable (voir ci-dessus)
- Élimination de perchlorate de l'eau potable.
- Élimination de métaux lourds dans les eaux résiduaires : Cd, Cr, Fe, Hg, Ni, Pb, Zn.
Certains contaminants sont néanmoins difficile à éliminer par échange d'ions en raison de la faible sélectivité des résines. Exemples : As, F, Li. Voir mon tableau de classification périodique des éléments qui contient certaines données sur la possibilité d'éliminer chaque élément par échange d'ions. Voir aussi la page sur les types de résines (résines sélectives) et une autre page couvrant les procédés d'échange d'ions en eau potable.
Autres informations
Abréviations
Nous avons utilisé ici les abréviations anglo-saxonnes :
- SAC : résine échangeuse de cations fortement acide (strongly acidic cation exchange resin).
- WAC: résine échangeuse de cations faiblement acide (weakly acidic cation exchange resin).
- SBA : résine échangeuse d'anions fortement basique (strongly basic anion exchange resin).
- WBA : résine échangeuse d'anions faiblement basique (weakly basic anion exchange resin).
L'eau
Voir les détails d'analyse d'eau requis pour les procédés ci-dessus.
Applications en traitement d'au potable.
Colonnes d'échangeurs d'ions
De nombreux types de colonnes sont décrits dans une page séparée. Les dégazeurs également. Et les principes de base du dimensionnement. Ces trois pages sont en anglais.
Régénération
Voir le détail des procédés de régénération, avec les quantités et concentrations des régénérants.
Réactions d'échange
Une page complète sur l'équilibre et les réactions d'échange des résines (en anglais).