Les bases de l'échange d'ions
Introduction
 L'échange d'ions est une technologie puissante, bien que peu connue du grand public. Cette page de vulgarisation tente de décrire l'échange d'ions en termes simples, pour les non spécialistes.
L'échange d'ions est une technologie puissante, bien que peu connue du grand public. Cette page de vulgarisation tente de décrire l'échange d'ions en termes simples, pour les non spécialistes.
Quand mes amis me demandent quelle est mon activité professionnelle, je réponds : "L'échange d'ions" La plupart d'entre eux n'ont aucune idée de ce que c'est. Pourtant en Europe de l'ouest, la majorité des foyers ont un ou deux appareils qui contiennent des résines échangeuses d'ions. Je leur demande alors : "Pourquoi mettez-vous du sel dans votre lave-vaisselle ?" Peu d'entre eux connaissent la réponse. Si vous êtes dans ce cas, vous la découvrirez plus bas.
L'eau
 L'eau est simple en apparence : c'est un liquide fait de molécules d'eau (formule H2O). Vous savez cependant que cette simplicité apparente est trompeuse, et que la réalité est plus complexe. Sinon, pourquoi croyez-vous que les vendeurs d'eau en bouteille feraient de telle publicité autour de sa minéralisation ?
L'eau est simple en apparence : c'est un liquide fait de molécules d'eau (formule H2O). Vous savez cependant que cette simplicité apparente est trompeuse, et que la réalité est plus complexe. Sinon, pourquoi croyez-vous que les vendeurs d'eau en bouteille feraient de telle publicité autour de sa minéralisation ?
Toutes les eaux naturelles contiennent des substances étrangères, généralement en faible concentration. L'eau de la rivière, une eau de forage, l'eau de votre robinet n'est pas juste H2O, elle contient aussi, en petites quantités :
- Des substances solides, insolubles, comme du sable ou des débris végétaux. En principe, vous pouvez les filtrer.
- Des substances solubles, que vous ne voyez pas la plupart du temps et que l'on ne peut pas filtrer. Ces substances peuvent être d'origine minérale ou organique, elles peuvent être ionisées (chargées électriquement) ou non.
Les substances solubles non ionisées existent dans l'eau sous forme de molécules de taille et de formule variable, par exemple :
- Le gaz carbonique (les bulles de votre Perrier) est une petite molécule avec une formule simple : CO2.
- Le sucre (saccharose) est une molécule plus grande avec une formule compliquée, abrégée en C12H22O11. Voulez-vous voir la formule développée en trois dimensions ? Les sucres ne sont cependant pas fixés sur des résines échangeuses d'ions.
Si vous voulez éliminer de l'eau ces substances étrangères, vous pouvez utiliser l'échange d'ions pour celles qui sont ionisées ou ionisables.
Ions
Les matières solubles ionisées dissoutes dans l'eau sont présentes sous forme d'ions, qui sont des atomes ou des molécules chargées électriquement. Les ions de charge positive sont appelés cations, et ceux de charge négative sont appelés anions. Comme l'eau est électriquement neutre globalement — sinon vous recevriez un choc électrique en y plongeant la main — le nombre de charges positives et de charges négatives est exactement le même.
Les ions peuvent avoir une ou plusieurs charges, le plus souvent entre 1 et 3. Les ions peuvent être constitués d'un seul atome (ions monoatomiques), ou de plusieurs atomes attachés ensemble, comme les molécules (ions polyatomiques).
Exemples :
- Un cation monovalent monoatomique : l'ion sodium Na+
- Un cation divalent monoatomique : l'ion calcium Ca++
- Un cation monovalent polyatomique : l'ion ammonium NH4+
- Un anion monovalent monoatomique : l'ion chlorure Cl–
- Un anion monovalent polyatomique : l'ion nitrate NO3–
- Un anion divalent polyatomique : l'ion carbonate CO3=
- Un autre anion divalent polyatomique (complexe métallique) : l'ion chromate CrO4=
- Le cation trivalent aluminium Al+++ n'existe que dans des solutions très acides, pas dans l'eau “normale”.
- De même, il n'y a pas d'anions monoatomiques di ou trivalents dans l'eau.
Dans l'eau, les ions sont libres de se mouvoir, ils ne sont pas fixes, et ils ne sont pas attachés à des ions de charge opposée. Seule la somme des charges des cations et celle des anions est identique. Voir la figure 1 pour une représentation schématique des ions dans l'eau.
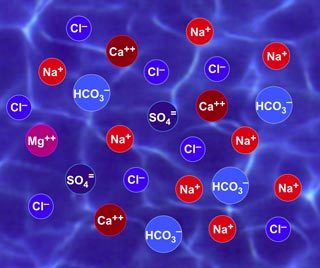
Figure 1 : Les ions dans l'eau ne sont pas attachés. La somme des charges est constante.
Les sels sont des substances cristallisées contenant une proportion fixe de cations et d'anions. Par exemple, le sel de table a exactement le même nombre de cations sodium (Na+) et d'anions chlorure (Cl—). Sa formule est NaCl. Quand vous dissolvez du sel dans de l'eau, ses cations et anions se déplacent librement comme dans la figure 1.
Dans l'eau, les ions sont faiblement liés aux molécules d'eau. On dit qu'ils sont hydratés. Les cations sont attirés par l'atome d'oxygène O, les anions par les atomes d'hydrogène H de la molécule d'eau H2O, comme dans la figure 2.
Substance ionisée dissoute dans l'eau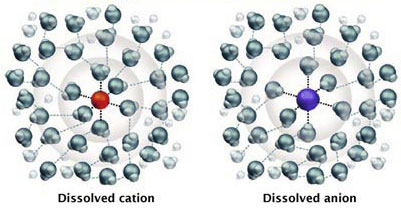
Figure 2 : Ions hydratés, ici Na+ en rouge et Cl– en bleu (sel de table NaCl)
Le sulfate de magnésium est un sel avec exactement le même nombre de cations magnésium (avec une charge double : Mg++) et d'anions sulfate (également avec une charge double, SO4=). La formule de ce sel est donc MgSO4.
Le chlorure de calcium est fait d'ions calcium (avec 2 charges, Ca++) et d'ions chlorure (avec 1 charge seulement, Cl–). Il faut donc 2 anions chlorure pour équilibrer chaque cation calcium. La formule du chlorure de calcium est par conséquent CaCl2.
De façon analogue, le carbonate de sodium a des cations sodium Na+ et des anions carbonate CO3=, et il vous faut donc deux ions sodium pour chaque carbonate, ce qui donne la formule Na2CO3.
Quand vous faites bouillir de l'eau, si vous la laissez s'évaporer complètement, vous vous retrouvez avec un résidu sec qui est fait de sels et peut-être d'autres substances comme de la silice ou des composés organiques. Seule l'eau de mer laissera une masse non négligeable de résidu sec, de 30 à 40 g par litre d'eau. Si c'est de l'eau de rivière ou du robinet, ce résidu sera très petit, de l'ordre de 50 à 500 mg/L. Il s'agit des solides dissous totaux (abréviation TDS en anglais).
Ces substances étrangères peuvent être éliminées par échange d'ions, à condition qu'elles soient dissoutes et ionisées. Voir des détails dans l'analyse d'eau et les unités de concentration en usage dans l'échange d'ions. Ce qui compte, c'est le nombre de charges, donc l'unité utilisée n'est ni la masse (g), ni la molarité (mol), mais la masse équivalente :
1 eq = 1 mol / valence
Une mole de sodium (Na+) contient 23 g de métal. Comme le sodium est monovalent, un équivalent de Na+ correspond aussi à 23 g. Mais une mole de nickel (Ni++) contient 58.7 g de métal, et un équivalent de Ni++ ne pèse que 29.35 g.
L'échange d'ions
Impuretés de l'eau
Comme nous l'avons vu, l'eau contient de faibles quantités de substances étrangères. Dans beaucoup de cas, ces substances ne causent aucun problème. Boire de l'eau contenant une certaine salinité est meilleur pour la santé que de l'eau ultra-pure. Pour certaines applications, en revanche, ces substances sont considérées comme des impuretés et doivent être éliminées.Les substances insolubles (sable etc.) peuvent être enlevées par filtration. Il existe de nombreuses technologies de filtration, jusqu'à l'ultrafiltration qui peut éliminer des particules inférieures à un micron. Pour les substances solubles, d'autres techniques sont nécessaires
Les substances solubles ionisées peuvent être éliminées par échange d'ions.
Les résines échangeuses d'ions
Ce sont de minuscules billes de plastique, d'un diamètre d'environ 0,6 mm. Ces billes sont poreuses et contiennent de l'eau, invisible et inamovible. On mesure la teneur en eau et on l'exprime en “rétention d'humidité”. La structure de la résine est un polymère (comme tous les plastiques) sur lequel un ion fixe a été fixé de façon permanente. Cet ion ne peut pas être enlevé ou remplacé : il fait partie de la structure. Pour préserver la neutralité électrique de la résine, chacun de ces ions fixes doit être neutralisé par un contre-ion de charge opposée. Ce contre-ion est mobile et peut sortir de la résine ou y entrer. La figure 3 représente schématiquement des billes échangeuses de cations et d'anions. Les lignes grises représentent le squelette polymère de la résine : il est poreux et contient de l'eau. Les ions fixes de la bile échangeuse de cations sont des sulfonates (SO3–) attachés au squelette. Dans cette image, les ions mobiles sont des cations sodium (Na+). Les résines échangeuses de cations, comme l'Amberjet 1000, sont souvent livrées sous forme sodium.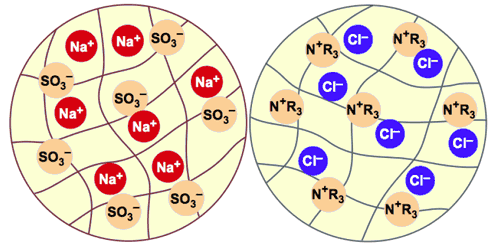
Figure 3 : Représentation schématique de billes de résines échangeuses de cations et d'anions
La bille échangeuse d'anions a un squelette très semblable. Les groupes fonctionnels sont ici des ammoniums quaternaires, donc des cations, représentés par la formule N+R3; une formule plus précise serait CH2-N+-(CH3)3. Les ions mobiles présents dans la bille d'échangeur d'anions sont ici des anions chlorure (Cl—). La forme chlorure est également la forme de livraison de beaucoup d'échangeurs d'anions. Tout ion pénétrant dans la résine produit la sortie d'un ion de même charge pour préserver l'électroneutralité. C'est ce que l'on appelle l'échange d'ions. Seuls les ions de même signe sont échangés. On ne peut pas produire une résine qui échangerait à la fois les cations et les anions, car les cations fixes à l'intérieur de la bille neutraliseraient les anions fixes, et aucun échange avec le monde extérieur ne serait possible. Il faut donc fabriquer séparément les résines échangeuses de cations et les résines échangeuses d'anions.
Des détails sur la structure des résines sont donnés dans une page séparée (en anglais).
Adoucissement d'eau
Parmi les substances dissoutes dans l'eau, on trouve très fréquemment la dureté. La dureté est une expression familière qui représente principalement les sels de calcium et le magnésium présents dans l'eau. Dans certaines conditions, ces ions peuvent précipiter et former des dépôts, le “tartre” que vous aurez vu dans votre bouilloire et qui peut obstruer les conduites d'eau chaude et encrasser les chaudières. L'adoucissement de l'eau est l'élimination de cette dureté : les ions entartrants (Ca++ et Mg++) sont échangés contre des ions qui ne forment pas de tartre, car ils sont beaucoup plus solubles : les ions sodium Na+.
Pour adoucir l'eau, vous prenez une résine échangeuse de cations dans laquelle les ions mobiles à l'intérieur de la résine sont du sodium (Na+) et vous faites passer l'eau à travers une colonne remplie de cette résine sous forme sodium. Les ions Ca++ et Mg++ constituant la dureté passent de l'eau dans la résine, et chacun de ces ions divalents est remplacé dans l'eau par deux ions sodium qui quittent la résine. La réaction d'échange peut s'écrire :
2 RNa + Ca++  R2Ca + 2 Na+
R2Ca + 2 Na+
La figure 4 illustre cette réaction : les billes de résine sont initialement chargées avec des ions sodium (Na+).Comme on le voit schématiquement, chaque ion calcium ou magnésium qui pénètre dans la résine est remplacé par deux ions sodium qui en sortent. Les anions présents dans l'eau — qui ne sont pas représentés ici — ne peuvent pas entrer dans la résine, car ils seraient repoussés par les anions sulfonate fixes (SO3—) de la résine.
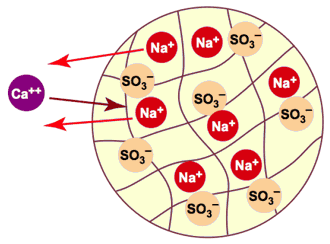
Figure 4 : Adoucissement (échange sodium) dans une bille de résine
Cet échange de cations ne peut avoir lieu de façon efficace que parce que la résine échangeuse de cations a une affinité plus grande pour les cations formant la dureté que pour le sodium. En termes simples la résine préfère le calcium et le magnésium au sodium. Le résultat de l'opération d'adoucissement n'est pas une élimination nette des ions “durs” de l'eau, mais simplement leur remplacement par des ions sodium.
Il est évident que cet échange n'est pas illimité : après un certain temps, la résine a enlevé tant d'ions calcium et magnésium de l'eau qu'il n'y a plus de place pour en accueillir d'autres. La phase dite d'épuisement (ou de saturation) est alors terminée, et il faut remplacer la résine par une charge neuve, ou la régénérer (voir plus bas).
Déminéralisation
Si vous remplacez tous les cations dissous dans l'eau par des ions H+ et tous les anions par des ions OH—, ceux-ci vont se recombiner pour former de nouvelles molécules d'eau. Pour y parvenir, il vous faut une résine échangeuse de cations sous la forme H et une résine échangeuse d'anions sous la forme OH. Tous les cations et anions de l'eau seront échangés, et le résultat net est une “disparition” complète des contaminants ionisés. La réaction d'échange de cations sera :
2 R'H + Ca++  R2Ca + 2 H+
R2Ca + 2 H+
R'H + Na+  R'Na + H+
R'Na + H+
Dans ces équations, R' représente la résine échangeuse de cations. L'échange est illustré dans la figure 5. La résine est initialement sous forme hydrogène (H+). Les anions ne sont pas montrés dans cette illustration. Vous voyez qu'un ion calcium Ca++ pénétrant dans la résine cause la sortie de deux ions H+, tandis qu'un ion Na+ est échangé contre un ion H+.
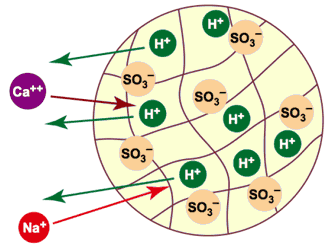
Figure 5 : Décationisation (tous les cations sont remplacés par H+).
De la même façon, une résine échangeuse d'anions sous forme OH– peut éliminer tous les anions :
R’’OH + Cl–  R’’Cl + OH–
R’’Cl + OH–
2 R’’OH + SO4=  R’’2SO4 + 2 OH–
R’’2SO4 + 2 OH–
où R’’ représente la résine échangeuse d'anions. Tous les anions sont remplacés par des ions hydroxyde (OH–). Il n'y a pas ici d'illustration de cet échange d'anions, car il est en tout point semblable à l'échange de cations illustré par la figure 5.
À la fin du processus d'échange, les billes de résine ont fixé tous les cations et anions présents dans l'eau et les ont remplacés par des ions H+ et OH– ions. Les résines sont presque entièrement saturées (fig. 6).
Ces ions H+ et OH– se recombinent instantanément pour créer de nouvelles molécules d'eau :
H+ + OH–  HOH
HOH  H2O
H2O
Les contaminants ionisés ont été fixés sur les deux résines (Na, Ca et Mg sur l'échangeur de cations, Cl, SO4 et HCO3 sur l'échangeur d'anions) et l'eau a été complètement déminéralisée. Sa salinité est réduite à presque rien, quelques ions qui ont pu s'échapper des colonnes de résine, et que l'on appelle fuite ionique.
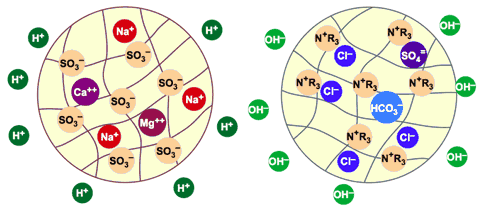
Figure 6 : Les billes de résine sont saturées.
Des ions H+ et OH– ont été relâchés dans l'eau.
La déminéralisation peut donc être schématisée dans l'image suivante :
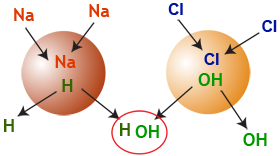
Figure 7 : La déminéralisation en une seule image !
Régénération
Une fois les résines saturées, on peut les remettre sous leur forme initiale et renouveler l'opération d'échange. L'échange d'ions est donc un procédé cyclique, et non continu. La régénération des résines se fait selon des réactions inverses de celles montrées précédemment.
Régénération d'un adoucisseur
La résine d'adoucissement est régénérée avec des ions sodium (Na+) fournis par une solution de chlorure de sodium (NaCl, ou sel commun). La réaction de régénération est :
R2Ca + 2 NaCl  2 RNa + CaCl2
2 RNa + CaCl2
 La régénération ne peut se faire que quand la concentration du régénérant est élevée, typiquement 1000 fois plus haute que la concentration dans de l'eau normale. Par exemple, le sel est utilisé dans une saumure à une concentration de 10 % (environ 100 g/L) pour régénérer un adoucisseur.
La régénération ne peut se faire que quand la concentration du régénérant est élevée, typiquement 1000 fois plus haute que la concentration dans de l'eau normale. Par exemple, le sel est utilisé dans une saumure à une concentration de 10 % (environ 100 g/L) pour régénérer un adoucisseur.
Vous avez maintenant compris pourquoi vous mettiez du sel dans votre lave-vaisselle : le sel dilué dans de l'eau régénère la résine contenue dans la cartouche d'adoucissement, habituellement invisible et située dans le bas de le machine.
Régénération d'un déminéraliseur
Pour la déminéralisation, des acides forts comme l'acide chlorhydrique (HCl) ou l'acide sulfurique (H2SO4) sont entièrement dissociés en solution et peuvent fournir les ions H+ nécessaires au remplacement des ions fixés pendant l'épuisement de la résine et qui sont maintenant dans celle-ci :
R’Na + HCl  R’H + NaCl
R’H + NaCl
De même, des bases fortes — en pratique on utilise toujours la soude caustique NaOH — peuvent fournir les ions OH— pour remplacer les anions fixés sur la résine :
R’’Cl + NaOH  R’’OH + NaCl
R’’OH + NaCl
Comme on le voit sur ces réactions de régénération, cette étape produit des effluents salins. C'est le principal inconvénient de l'échange d'ions.
Voir la description d'un cycle complet, et une autre page sur les procédés de régénération à co-courant et à contre-courant.
À quoi ressemble une résine
Cliquer sur les images

Échantillon d'AmberliteTM FPC23 |

Résines pour lits mélangés |

AmberjetTM 4400 |
Voir aussi d'autres images de résines sur une page séparée.
Exploitation en colonnes
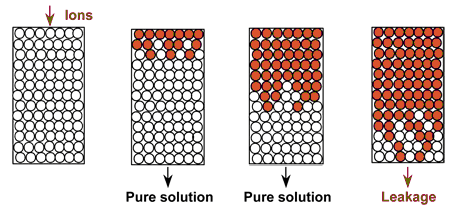 Tant au laboratoire que dans des installations industrielles, les résines échangeuses d'ions sont utilisées en colonne. L'eau ou la solution à traiter passe à travers la résine. Sur l'illustration de droite, on voit la résine fraîche, puis chargée peu à peu avec les ions en provenance de la solution à traiter. Des ions initialement sur la résine — que l'on ne voit pas ici — sont relargués dans la solution traitée. À la fin de l'opération, quelques-uns de ces ions “foncés” s'échappent dans la solution traitée (apparition de la fuite ou percement), et l'on arrête la phase d'épuisement.
Tant au laboratoire que dans des installations industrielles, les résines échangeuses d'ions sont utilisées en colonne. L'eau ou la solution à traiter passe à travers la résine. Sur l'illustration de droite, on voit la résine fraîche, puis chargée peu à peu avec les ions en provenance de la solution à traiter. Des ions initialement sur la résine — que l'on ne voit pas ici — sont relargués dans la solution traitée. À la fin de l'opération, quelques-uns de ces ions “foncés” s'échappent dans la solution traitée (apparition de la fuite ou percement), et l'on arrête la phase d'épuisement.
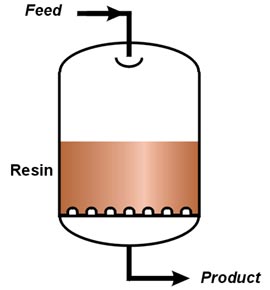
Les images suivantes montrent une colonne de laboratoire, une colonne industrielle schématisée et une installation industrielle de type AmberpackTM.
 |
 |
 |
| Au laboratoire | Colonne industrielle | Un AmberpackTM |
La carafe du début de cette page contient un petit filtre rempli de charbon actif et de résine échangeuse d'ions. La quantité de résine est d'environ 150 ml. À titre de comparaison, une colonne industrielle de grande taille peut contenir 20'000 L de résine, parfois davantage.
Capacité d'échange
Capacité totale
Le nombre de groupes actifs, ou groupes fonctionnels, constitue la capacité totale de la résine. Comme il y a des milliards de groupes dans une seule bille de résine, la capacité est habituellement exprimée en équivalents par litre de résine. Un équivalent correspond à 6,02×1023 groupes actifs. Vous n'avez pas besoin de retenir ce chiffre, appelé nombre d'Avogadro.
Une résine échangeuse de cations fortement acide typique a une capacité totale de 1,8 à 2,2 eq/L
Une résine échangeuse de cations faiblement acide typique a une capacité totale de 3,7 à 4,5 eq/L
Une résine échangeuse d'anions fortement ou faiblement basique a une capacité totale de 1,1 à 1,4 eq/L
Capacité utile
Dans l'illustration de l'exploitation en colonne du paragraphe précédent, la résine est totalement régénérée en début de cycle, mais n'est pas complètement saturée à l'arrêt de la phase d'épuisement. La définition de la capacité utile, ou capacité opératoire, est la différence entre les sites régénérés au début et à la fin de la phase d'exploitation. Elle est aussi exprimée en équivalents par litre.
En exploitation, la capacité utile de la résine s'élève à environ la moitié de sa capacité totale. La fourchette habituelle es de 40 à 70 % de la capacité totale, en fonction des conditions opératoires. Voir d'autres détails dans une page séparée.
 C'est le nombre d'ions et leur charge (une, deux ou trois charges par ion), et non leur masse, qui est important pour l'échange d'ions. En conséquence, toutes les analyses d'eau doivent être présentées pour avoir les masses (concentrations en mg/L) converties en équivalents (meq/L).
C'est le nombre d'ions et leur charge (une, deux ou trois charges par ion), et non leur masse, qui est important pour l'échange d'ions. En conséquence, toutes les analyses d'eau doivent être présentées pour avoir les masses (concentrations en mg/L) converties en équivalents (meq/L).Pourquoi exprime-t-on la quantité de résine en volume et non en poids ?
Pour le dimensionnement d'une colonne d'échange d'ions, c'est le volume de résine qui est important, et non sa masse. Les résines échangeuses d'ions ont des densités différentes (voir la page en anglais sur les propriétés des résines, par conséquent les résines sont vendues par unité de volume (en litres ou en mètres cubes). Beaucoup des propriétés des résines sont aussi exprimées par rapport au volume.
Qualité de l'eau traitée
Dans une déminéralisation typique, la qualité de l'eau traitée exprimée en conductivité est inférieure à 1 µS/cm. Si l'on considère que l'eau d'une rivière ou d'un puits a une conductivité dans la fourchette de 100 à plus de 1000 µS/cm, l'efficacité de l'échange d'ions varie entre 99 et plus de 99,9 %. D'autre procédés, comme l'osmose inverse, sont loin d'atteindre ces chiffres.
Limites de l'échange d'ions
Pour que l'échange d'ions soit efficace, il faut une différence d'affinité entre les ions en solution et l'ion sur la résine. La résine doit avoir une meilleure affinité pour les ions que l'on veut éliminer que pour ceux qui sont sur la résine au début de l'opération.
La technique de l'échange d'ions est l'outil parfait pour éliminer ou remplacer des contaminants présents en faible concentration. Dans de pareils cas, la durée d'épuisement de la résine peut être très longue, allant de quelques heures jusqu'à plusieurs mois. En revanche, si la concentration des contaminants est élevée, disons plusieurs grammes par litre d'eau ou de solution à traiter, le cycle d'échange devient ridiculement court et la consommation de régénérants augmente jusqu'à devenir rédhibitoire. Pour le traitement des eaux saumâtres (les eaux souterraines de forte salinité que l'on trouve dans les pays arides), l'échange d'ions n'est pas approprié et d'autres technologies doivent être utilisées, comme l'osmose inverse ou la distillation.
De plus, les contaminants non ionisés ne peuvent pas être éliminés par échange d'ions. D'autres technologies sont disponibles qui utilisent du charbon actif, des adsorbants synthétiques, des tamis moléculaires et d'autres médias filtrants. Certains types de filtration sur membranes, notamment l'ultrafiltration et la nanofiltration, peuvent offrir des solutions efficaces.
Échange d'ions sélectif
Grâce aux différences d'affinité avec divers ions, des résines échangeuses d'ions conventionnelles peuvent être mises en œuvre pour l'élimination sélective de certains ions. L'un des exemples les plus évidents est l'adoucissement, décrit plus haut. On ne peut pas adoucir l'eau par osmose inverse — c'est à dire enlever seulement les ions Ca++ et Mg++ — cette technique ne permettant qu'une déminéralisation partielle; seul l'échange d'ions permet d'éliminer la dureté avec une résine sous forme Na+. De même, on peut éliminer au moins partiellement les nitrates et les sulfates grâce à une résine échangeuse d'anions sous forme chlorure. Ceci fonctionne parce que la résine a plus d'affinité — ou une meilleure sélectivité — pour l'ion sulfate ou nitrate que pour l'ion chlorure, l'ordre d'affinité étant :
SO4= > NO3– > Cl– > HCO3– > OH– > F–
Il n'y a donc aucun moyen pratique — avec quelque procédé que ce soit — de n'éliminer que le chlorure de l'eau sans toucher aux autres anions.
Pour les résines échangeuses de cations utilisées en adoucissement, l'ordre est :
Pb++ > Ca++ > Mg++ > Na+ > H+
Le plomb (Pb) fait partie de la liste pour montrer que même de faibles traces de plomb dissous seront fixées efficacement par une résine d'adoucissement, de même que de nombreux autres métaux lourds (mais pas tous). Voir les tables de sélectivité pour les résines échangeuses de cations et d'anions.
Il est parfois difficile d'éliminer certains contaminants avec des résines classiques, principalement en raison de la “concurrence” avec d'autres ions non gênants. Dans de nombreux cas, des résines spécifiques ont été mises au point. Des résines sélectives sont aujourd'hui disponibles pour l'élimination du :
- Bore
- Nitrate
- Perchlorate
- Nickel
- Chromate
- Uranium
En dehors du traitement d'eau
Il y a un nombre considérable d'applications dans des domaines autres que le traitement d'eau. En voici quelques exemples :
- Adoucissement de jus sucrés de betterave avant évaporation
- Décoloration de sirops de canne
- Séparation chromatographique de glucose et fructose
- Déminéralisation de lactosérum, de glucose et de nombreux autres produits alimentaires
- Récupération de polyphénols destinés à l'industrie alimentaire
- Récupération d'uranium dans les mines
- Récupération d'or dans les bains de placage électrolytiques
- Séparation de métaux en solution
- Catalyse d'additifs antidétonants pour l'essence
- Extraction d'antibiotiques et d'autres substances dans des bouillons de fermentation
- Purification d'acides organiques
- Résines en poudre utilisées dans les formulations pharmaceutiques
Conclusion
 L'échange d'ions est une technologie puissamment efficace pour l'élimination d'impuretés dans l'eau et dans des solutions diverses. De nombreuses industries ne peuvent se passer de l'échange d'ions pour produire de l'eau d'une extrême pureté :
L'échange d'ions est une technologie puissamment efficace pour l'élimination d'impuretés dans l'eau et dans des solutions diverses. De nombreuses industries ne peuvent se passer de l'échange d'ions pour produire de l'eau d'une extrême pureté :
- Centrales électriques nucléaires et thermiques
- Semiconducteurs, puces informatiques et écrans plats
- Élimination sélective de contaminants dans l'eau potable
Voir le plan du site pour plusieurs pages de détail sur les applications, les procédés utilisés, les résines et d'autres sujets de l'échange d'ions.
Amberjet, Amberlite et Amberpack sont des marques de Rohm and Haas, une filiale de the Dow Chemical Company.










